いともたやすく行われるえげつない行為
たやさん (taxyach)の12/6の記事『p53の薬をつくる』のp53 Y220C Stabilizerの作用機序が非常に面白く、もしかしたらメドケムのテクとしてパターン化できないかなと思って他の事例も調べてみたが・・・全然無理だった。
PMV社のRezatapoptは、p53のY220がCに変異したことで失われたチロシン残基の相互作用を、インドール環で代替することで補っている。一方、Vertex社のTrikaftaは、変異部位から離れた複数の部位に結合する 2つのcorrectorがCFTR構造安定化し、さらに 1つのpotentiatorがチャネル開口を促進している。また、Amicus社のミガーラスタットは、α-Galの変異部位ではなく活性部位に結合して酵素全体を安定化し、多様な変異によって不安定化したα-Galのフォールディングを誘導する。
とはいえ、p53 Y220Cのように化合物が結合できる十分な空間が存在するのであれば、同様の局所安定化戦略を他の変異タンパク質にも応用できる可能性がある。
どジャアアあああ〰〰〰ン

【①PMV社のp53 Y220C reactivator】
Discovery of Rezatapopt (PC14586), a First-in-Class, Small-Molecule Reactivator of p53 Y220C Mutant in Development
ACS Med. Chem. Lett. 2025, 16, 1, 34–39
https://doi.org/10.1021/acsmedchemlett.4c00379
p53やRezatapoptについては、たやさん (taxyach)の記事を参照いただきたい。
https://taxyach.hatenablog.com/entry/2025/12/06/162850
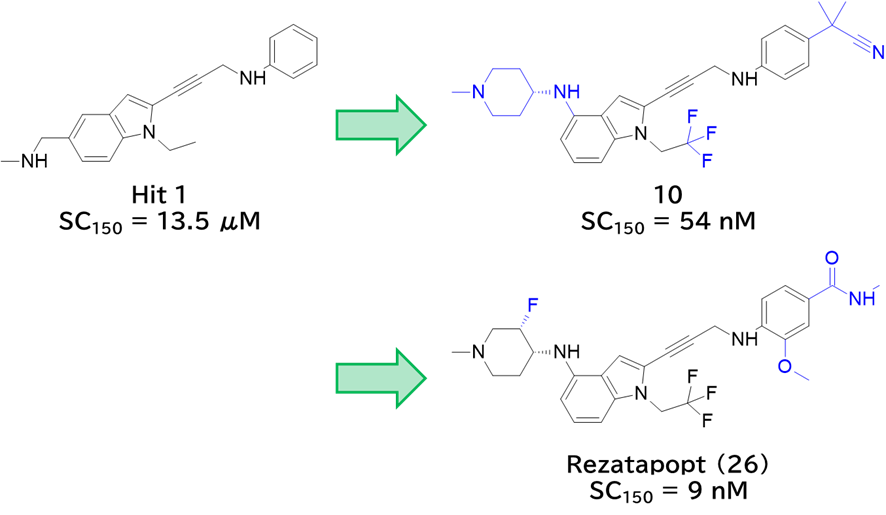
ここで改めて注目したいのは、化合物10とp53 Y220Cの相互作用である。
10は、p53のTyr残基がCysに置き換わった(変異した)ことで生まれたポケットにハマって相互作用を形成し、安定化している。
- 化合物10-p53 Y220C複合体のX線結晶構造解析 (9BR4)
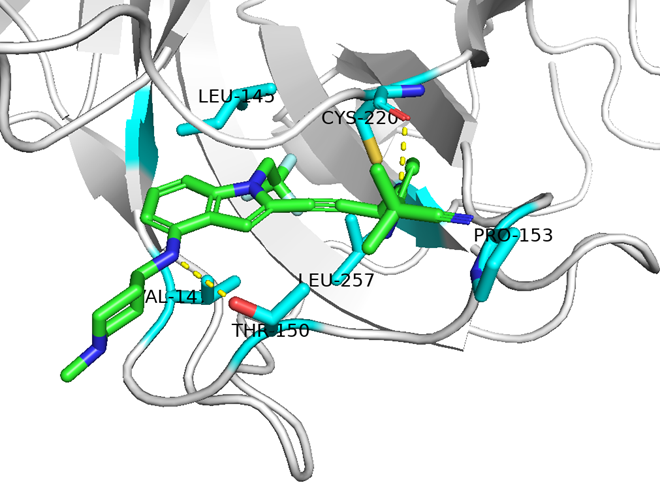
それでは、変異していないp53と比較してみると、どうだろうか?
周辺残基はほとんど動いていないように見える。そしてTyr残基があったところに10のインドール環がハマって代役を果たしているように見えなくもない。
- p53 (Y220変異なし)のX線結晶構造解析 (2OCJ)
他の化合物はどうだろうか?
MRC分子生物学研究所のMatthiasらが報告したMB710はベンゾチアゾール環がTyr220の代役を果たしてそう。
Aminobenzothiazole derivatives stabilize the thermolabile p53 cancer mutant Y220C and show anticancer activity in p53-Y220C cell lines
Eur J Med Chem. 2018, 152, 101-114.
https://doi.org/10.1016/j.ejmech.2018.04.035.

もしかしたら、Stabilizerのデザインコンセプトは、変異する前のアミノ酸残基と類似した構造の化合物(この場合は、フェノールの代わりにインドールやベンゾチアゾール)を代わりにハメてやれば良いのでは?
ということで、他の事例はどうだろうと、CFTRモジュレーターTrikaftaとα-Gal安定化剤ミガーラスタットの結合様式を調べてみた。
【②Vertex 社のCFTRモジュレーター】
CFは白色人種で頻度が高い(3,500人に1人)致死性の常染色体劣性遺伝疾患である。日本では患者数50未満の希少疾患だが、米国に約3万人、欧州に約4万人が存在する。
CFは塩化物イオンチャネルCFTR(Cystic fibrosis transmembrane conductance regulator)の遺伝子変異によって発症するが、その変異は2,000種類以上報告されており、表現型の違いによりクラス1~7に分類されている。
https://www.jstage.jst.go.jp/article/faruawpsj/56/1/56_31/_pdf/-char/ja
Trikaftaは3つの化合物(tezacaftor, elexacaftor, invacaftor)の3剤併用療法で、Vertex社によって創製・開発された。FDA承認年は2019末だが、2020年の時点で売上30億米ドルを超えており、2026年には約50億米ドルに達すると予想されている。対象はCFTRタンパク質のF508が欠損 (ΔF508)した患者である。
https://prtimes.jp/main/html/rd/p/000000860.000071640.html
それでは、Trikaftaの3化合物はどのような相互作用でCFTRΔF508を安定化しているのだろうか?
Molecular structures reveal synergistic rescue of Delta 508 CFTR by Trikafta modulators.
(2022) Science 378: 284-290
https://doi.org/10.1126/science.ade2216
CFTRはTMD1 (膜貫通ドメイン1)-NBD1 (ヌクレオチド結合ドメイン1)-RD (制御ドメイン)-TMD2-NBD1から成る。F508 は NBD1 の外側表面に存在し、CFTR の折り畳みと安定性に極めて重要である。
CFTR ΔF508-tezacaftor, elexacaftor, invacaftor複合体のCryo-EM構造解析を見ると、3化合物は、ΔF508周辺から完全に離れた場所に結合していた。
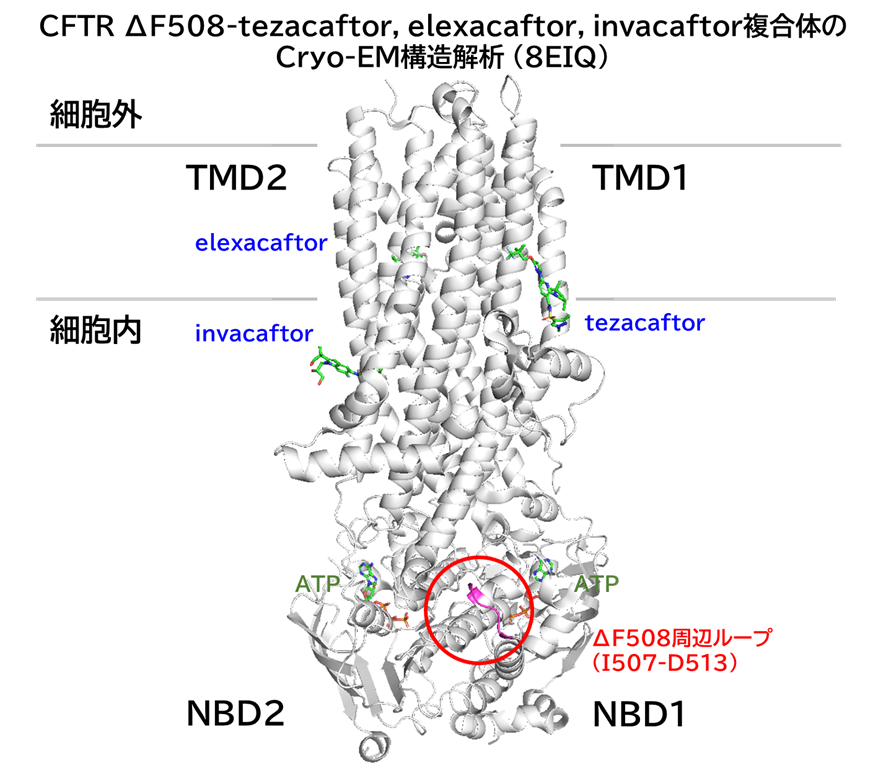
ロックフェラー大学 Karol らの報告で、小胞体膜に溶解した ΔF508/E1371Q CFTR を精製する際に、各化合物を加えて翻訳後の効果を観察したところ、
- Lumacaftor のみ:NBD1 は依然として乱れた状態(disordered、化合物なしと同様)
- Elexacaftor のみ:NBD1 は構造化されたが、NBD1–NBD2 の界面が完全には閉じず、いわば “cracked open” の状態
- Lumacaftor と Elexacaftor:NBD1 を含め全体の interdomain assembly が WT に近い形で構造化された状態(corrected)
- 3 化合物(Trikafta):構造的 rescue は 2 corrector の組み合わせと同様(corrected)。Ivacaftor は構造 rescue には寄与しない
であった。
Lumacaftor や Tezacaftor は type I corrector に分類され、CFTR に結合することで、CFTR 産生の早期段階で TMD1 を安定化させ、未成熟による分解を防ぐ機能を持っているようだ。一方で Elexacaftor は type III に分類され、CFTR に結合することで NBD1 を安定化するが、NBD1–NBD2 dimer の界面は完全には閉じず、不完全な状態にとどまっているようである。
そこで、2 化合物を組み合わせることで、WT CFTR とほとんど同様な完全構造の形成が誘導される。Ivacaftor は corrector ではなく potentiator としてチャネルを開口させ、塩化物イオンの流量を増やす役割を果たしている。
次に、上述のCryo-EM構造解析を元に、2つのcorrector (tezacaftorおよびelexacaftor)それぞれの結合様式を見てみよう。
・Tezacaftorは、TMD1のTM1/3/6に形成される疎水性ポケットに結合している。Lumacaftorではカルボキシ基がLys68と塩橋を形成することが報告されているが、今回の構造では両者が約7.5 Å離れており、塩橋は形成されていない。これはElexacaftor併用による全体構造の変化が影響している可能性もあるが、現時点では断定できない。
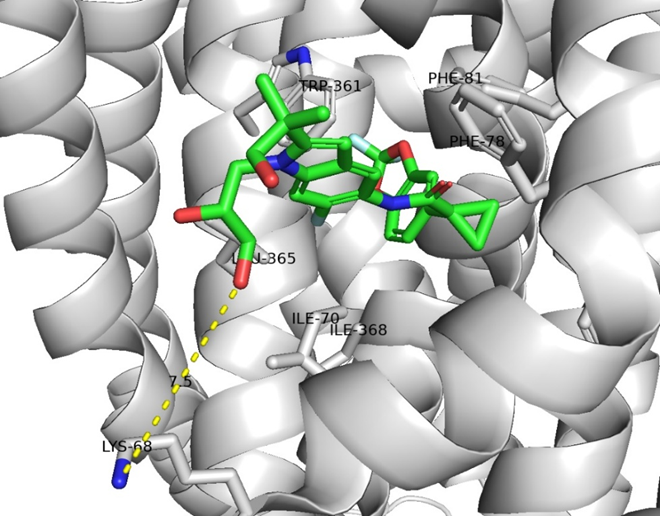
・Elexacaftorは、TMD1のTM2/10/11とlasso motifによって形成される疎水性ポケットに結合し、特にTM11残基との相互作用が顕著である。さらに、TM11の R1102, W1098やlasso motifのS18, R21と水素結合を形成している。R21はアポ体ではY1032と水素結合しているが、elexacaftor結合に伴いフリップして化合物側へ移動し、この再配置がTMD1–TMD2 界面の構造安定化に寄与している可能性がある。
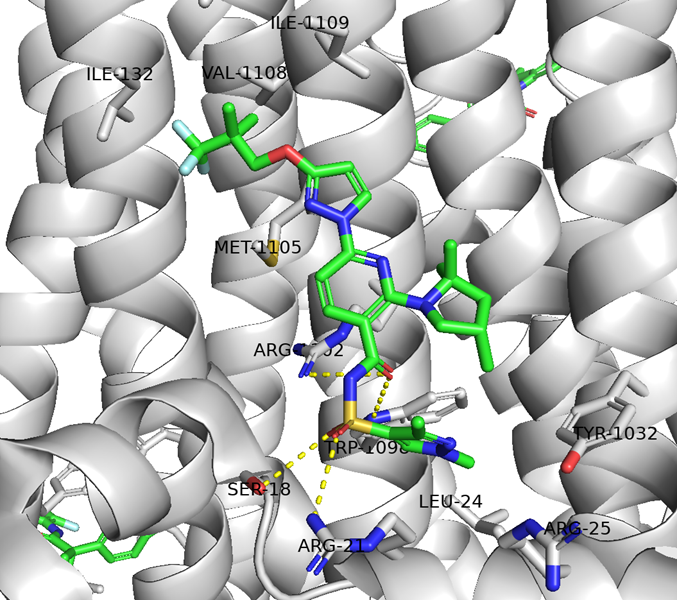
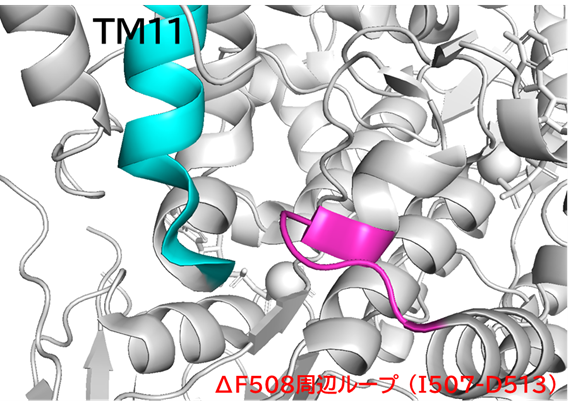
Elexacaftorは、TMD2側のTM11を安定化することで、ΔF508により破綻した NBD1–ICL4(TM10–11)界面の配置を部分的に回復している可能性がある。F508 が担っていたNBD1–TM11のパッキングが失われた状態でも、Elexacaftorがアロステリック部位からTM11を適切な位置に保持することで、NBD1 の構造化をサポートしていると考えられる。
【③Amicus 社のα-GAL安定化剤】
α-ガラクトシダーゼ (α-GAL)は、ライソゾームに存在する糖加水分解酵素である。この酵素が欠損すると細胞内に代謝産物が蓄積し、組織障害や最終的な臓器不全を招くファブリー病を引き起こす。ファブリー病の原因となる多くの変異は、α-GALをコードするGLA遺伝子で同定されており、多くの変異体は、翻訳後に小胞体内においてタンパク質の折りたたみ異常により分解される。
現在、ファブリー病の治療法は酵素補充療法とシャペロン療法がある。シャペロン療法は、イミノ糖である1-デオキシガラクトノジリマイシン(ミガーラスタット)が折りたたまれた酵素を安定化し、小胞体関連分解を抑制すると考えられている。
Amicus社は、ミガーラスタットの2024年度の売上は4億5,810万米ドルであったと報告している。
ちなみにAmicus社はBioMarin社に48億米ドルで買収されるとの記事が12/19に。
https://firstwordpharma.com/story/6806734
それでは、ミガーラスタットはどのような相互作用でα-GALを安定化しているのだろうか?
The molecular basis of pharmacological chaperoning in human alpha-galactosidase
(2011) Chem Biol 18: 1521-1526
https://doi.org/10.1016/j.chembiol.2011.10.012
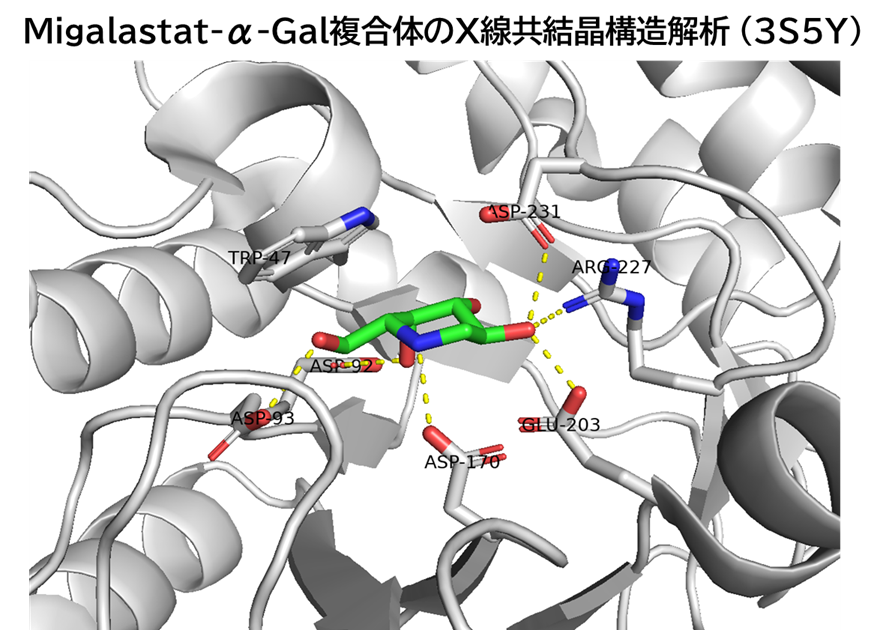
ミガーラスタットも変異部位に結合しているわけではなかった。
α-Gal の活性部位に可逆的に結合し、変異によって不安定化した酵素の折りたたみ平衡をnative側へシフトさせることで小胞体での分解を回避させる。そしてライソゾームに到達すると酸性環境で活性部位から解離し、α-Galは不安定ながらも糖加水分解酵素として機能する。したがって、基質分解能そのものが失われた変異には効果を示さない。
まとめると、
PMV社の RezatapoptとVertex 社の Trikafta、Amicus 社のミガーラスタットは、それぞれ異なるアプローチで標的タンパク質を安定化しており、メドケムのテクとしてパターン化するのは難しかった。
とはいえ、CFTRの事例を見直すと、Δ508 CFTRにV510Dを導入すると、R1070 残基と静電相互作用を形成することで、NBD1-TMD1界面を安定化できるそうだ(論文にはI510Dと書いてあるが、Vだったので誤記かな)。また、WT CFTRにR1070Wを導入するとF508残基と立体反発で不安定化するが、Δ508 CFTRにR1070W を導入するとインドール環が、F508欠失によって生じた空隙を埋めることで、NBD1-TMD1界面を安定化できるそうだ。
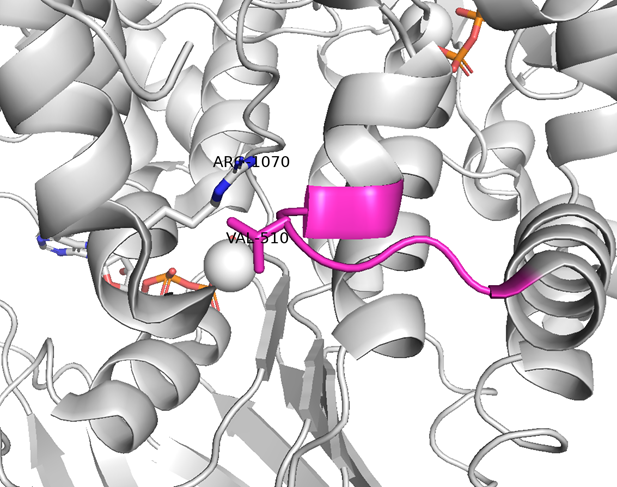
つまり、p53 Y220Cのように化合物が結合できる十分な空間が存在するのであれば、上述のトリプトファンのインドール環やアスパラギン酸のカルボキシ基を持った化合物をハメることで安定化できる可能性はある(この場合、モレキュラーグルーに該当するかな)。ただし、今回は化合物がハマるスペースはなさそうだが。
いやぁ、メドケムって本当にいいものですね。