あれはまさに
Kymera社のCDK2 degraderおよびBMS社のBCL6 degraderの創製。それぞれ学びになる検討内容だが、共通して注目したいのは、標的タンパク質とCRBNがタンパク質間相互作用を形成している点。以前にアステラスのKras degraderの記事でも述べたが、最初に標的タンパク質とE3 ligaseのタンパク質間相互作用を予測して、化合物は後からその間にハマるようにデザインすることもできるかも。
かたや3人!!
あれはまさに
合体!!!

【Kymera社のCDK2 degrader】
Discovery of Selective and Orally Bioavailable Heterobifunctional Degraders of Cyclin-Dependent Kinase 2
J. Med. Chem. 2025, 68, 18407–18422.
https://doi.org/10.1021/acs.jmedchem.5c01160.
CDK(サイクリン依存性キナーゼ)はセリン/スレオニンキナーゼであり、サイクリンとの複合体形成と翻訳後修飾によって活性化され、RNA転写や細胞周期進行を制御する。CDKの異常活性化は制御不能な細胞増殖を誘発し、がんの発症・進展に関与するため、CDK阻害は有望な治療戦略とされる。近年CDK4/6阻害剤がFDA承認されたが、代償経路としてCDK2が同定され、CDK2標的治療への関心が高まっている。一方、CDKはATP結合部位が高度に保存されているため選択性が乏しく、特に細胞増殖に必須なCDK1との識別が臨床応用の制約となってきた。最近はCDK2分解剤NXT3964が臨床試験に進み、分解誘導型アプローチの有効性が示唆されている。
そこでKymera社は、CDK2選択性を有する化合物を基盤にProtein degrader化することで、さらなる選択性向上と経口投与可能性の実現を目指した。
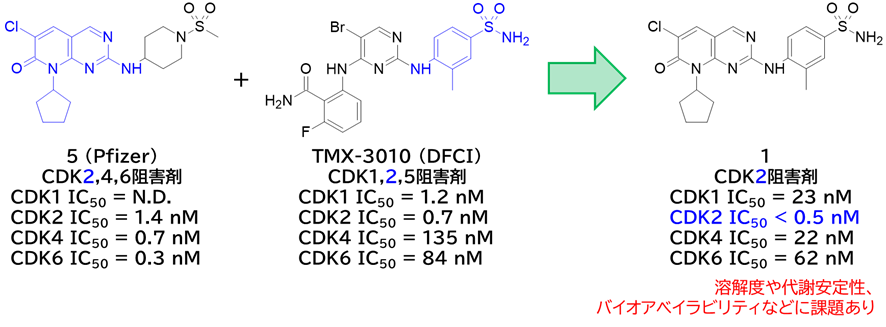
① 既知化合物の構造を組み合わせてCDK2選択的阻害剤7を取得
・ Pfizer社のCDK2,4,6阻害剤とダナ・ファーバー癌研究所のCDK1,2,5阻害剤をハイブリッドしてCDK2選択的な1を取得
✓ トリル基が選択性の肝(CDK2と相互作用するが、CDK4/6と相互作用しない)
✓ 溶解度や代謝安定性、バイオアベイラビリティなど物性に課題あり
→ 縮間の削減によるFsp3向上やヒドロキシ基導入などで物性改善を目指す
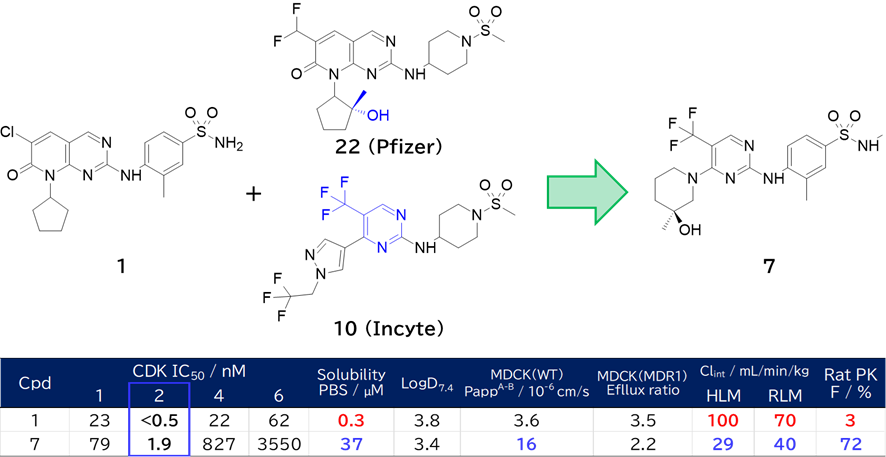
・ 1にPfizer社のヒドロキシ基とIncyte社のピリミジン環を取り入れて7を取得
✓ 溶解度と代謝安定性、バイオアベイラビリティが改善、しかも選択性も向上
✓ アミノピリミジンはCDK2 ATP結合部位のヒンジ領域Leu83主鎖と水素結合
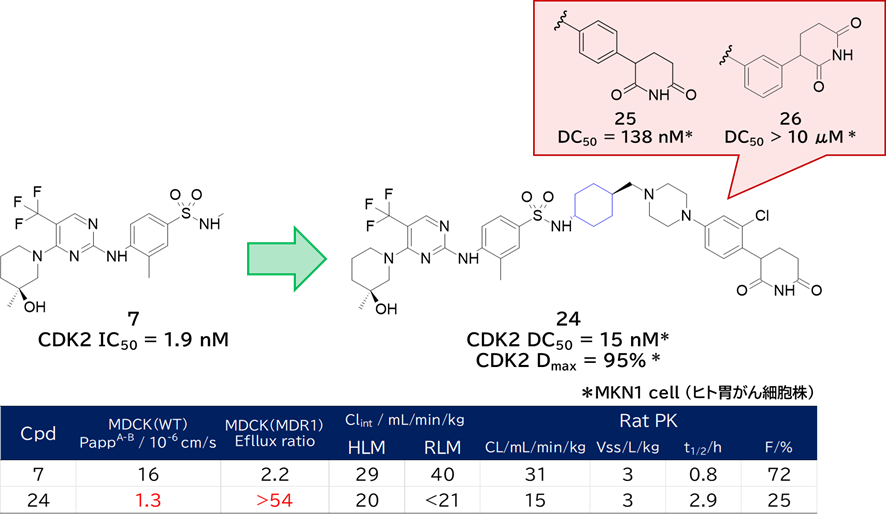
② 7とCRBNリガンドをリンカーでつないでCDK2 degrader 24を取得
・ スルホンアミドの隣をシクロヘキシル基にして代謝安定化
✓ アルキルスルホンアミドの開裂が主要な代謝経路
✓ スルホンアミドがα位の炭素ラジカルを安定化させて酸化速度を増加させる
→ 立体障害によって酸化的代謝を防ぐ
・ 3D-PSAは低いほうがバイオアベイラビリティ改善の傾向あり
・ 経口吸収性を改善する取り組み
a) 水素結合ドナーNHの近傍を嵩高くする
b) アミノ基の塩基性を下げる(電子吸引性基を入れたり嵩高くしたり)
c) CRBNリガンドの分子サイズや水素結合ドナー削減(今回はこれが一番効果あった)
・ リンカーを短くすると、物性改善だけでなく、三者複合体を形成しやすくなって分解能が向上
✓ 短すぎると分解能は下がる
・ CRBNリガンドのクロロ基を無くすと活性激減、グルタルイミドの位置を変えると活性消失
③ 化合物の構造最適化を経て37を取得
・ 24はCYP3A4 Time dependent inhibition (TDI)あり
✓ o-メチルアニリン構造から反応性代謝物キノンメチド生成したためと推定
→ メチル基をフルオロ基に変換して回避(メチル基のフッ素化やD化は効果なかった)
・ 37のプロファイリング
✓ CDK1,4,6,9と75倍以上の選択性あり
✓ プロテオーム解析でCDK2選択的な分解活性
✓ ラット、イヌ、サルで良好なPK
✓ HCC1569ゼノグラフトモデルマウスに経口投与(QD, BID)で腫瘍体積の増加を抑制

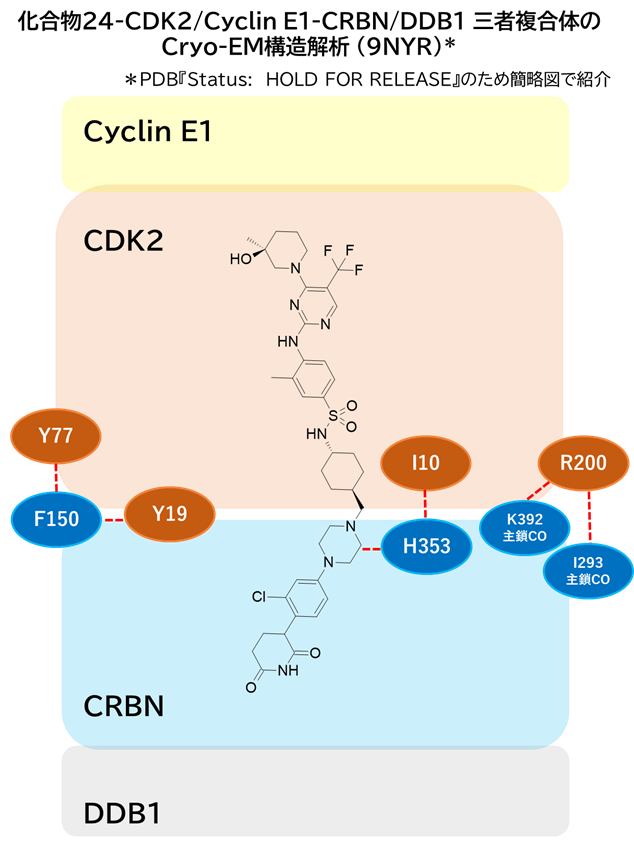
④ 24-CDK2/Cyclin E1-CRBN/DDB1 三者複合体のCryo-EM構造解析
・ 注目すべきはCDK2とCRBNのタンパク質間相互作用が観察されたこと
✓ CDK Tyr77,19残基がCRBN Phe150残基とサンドイッチ(π-π相互作用)
✓ CDK Ile10主鎖カルボニル基とCRBN His353残基が水素結合
→ 24のピペラジンリンカー部分も相互作用してサポートしているかも?
✓ CDK Arg200残基をCRBN Lys392, Ile293主鎖カルボニル基が水素結合
【Bristol Myers Squibb (BMS)社のBCL6 degrader】
Discovery of Potent and Selective BCL6 Ligand-Directed Degrader (LDD), BCL6-760
J. Med. Chem. 2025, 68, 21502–21519.
https://pubs.acs.org/doi/10.1021/acs.jmedchem.5c01645.
B-cell lymphoma 6 (BCL6)は、アポトーシス、細胞周期、DNA損傷チェックポイントに関わる遺伝子発現を負に制御する転写制御因子である。BCL6 が異常発現すると、制御不能な悪性 B 細胞の増殖と腫瘍形成が促進される。非ホジキンリンパ腫 (NHL) のサブタイプであるびまん性大細胞型リンパ腫 (DLBCL) や濾胞性リンパ腫は BCL6 の恒常的発現と関連しており、新規診断 DLBCL 患者の約 20% がこの癌遺伝子を過剰発現している。
BCL6 を標的とするアプローチとして、N 末端 BTB ドメインに結合する低分子が有効であると報告されているが、臨床開発に進んだ化合物は存在しない。一方、BCL6 degrader として BMS-986458 や ARV-393 が臨床試験に進んでいる。
今回 BMS は、BMS‑986458 に続く BCL6 LDD プログラムの一環として、経口投与で in vivo DLBCL 移植腫瘍モデルにおいて薬効を示した BCL6‑760 を見出した。
① 既知化合物とCRBNリガンドをリンカーでつないでBCL6 degrader 2を取得
・ Boehringer Ingelheim社のBI-3812 (1)を採用
✓ 固有の分解活性がないことに着目
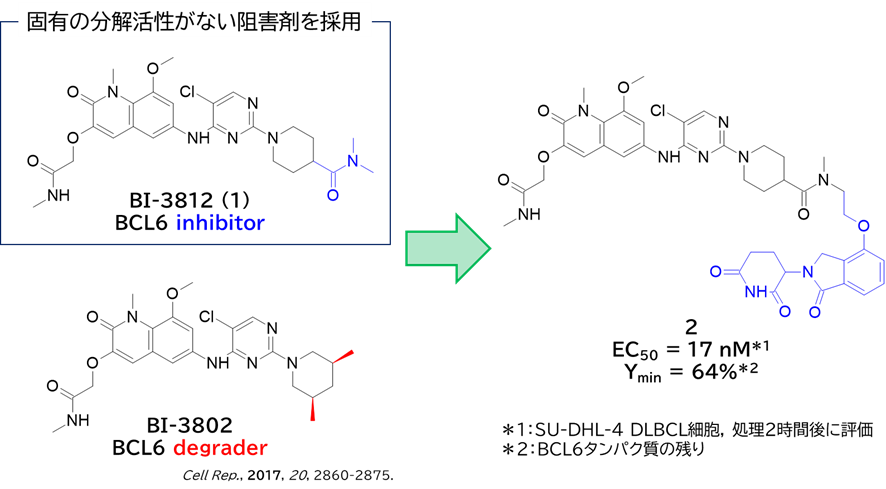
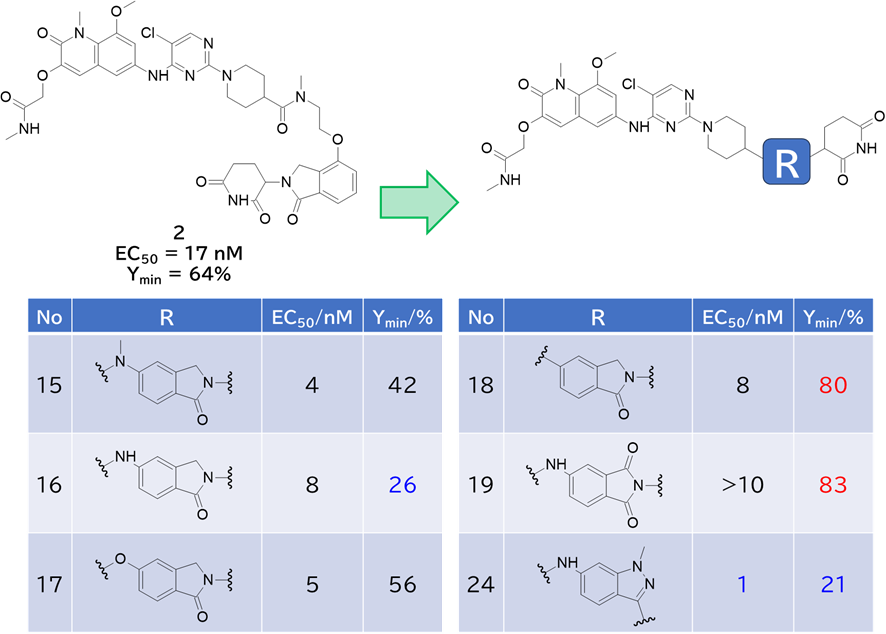
② CRBNリガンドを含むリンカーの検討を経て24を取得
・ CRBNリガンドを繋ぐのはNH>NMe>Oの傾向があった
・ リンカーを短くすると、三者複合体を形成しやすくなって分解能が向上
✓ 短すぎると分解能は下がる
・ 驚くべきは、一般的なサリドマイド構造で分解活性が消失したこと
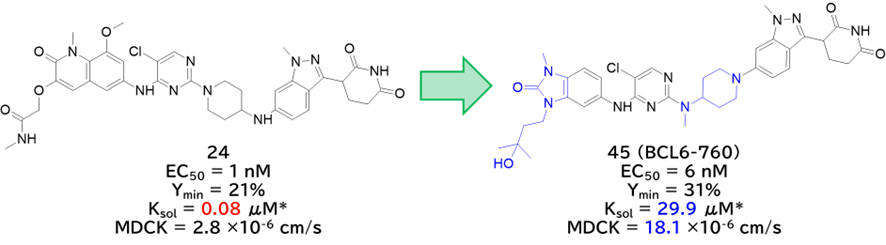
③ 24から更なる合成展開を経て45 (BCL6-760)を取得
・ 24は溶解度に課題あり、縮環を変換してヒドロキシ基を導入して改善
✓ その後、もう一度リンカーの検討をやり直し
・ 45のプロファイリング
✓ プロテオーム解析でBCL6選択的な分解活性
→ サリドマイドのネオ基質IKZF1,3,CK1α,GSPT1,SALL4を触っていない
✓ OCI-LY-1ゼノグラフトモデルマウスに経口投与(BID)で用量依存的なBCL6タンパク質の減少と腫瘍体積の増加を抑制
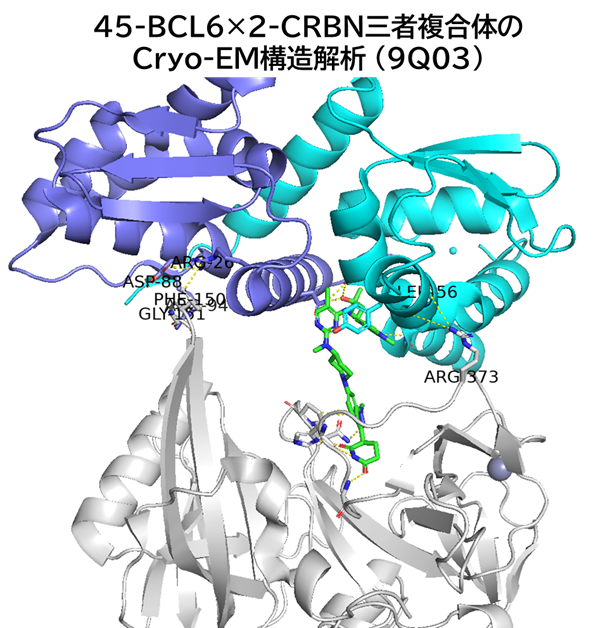
④ 45-BCL6(二量体)-CRBN 三者複合体のCryo-EM構造解析
・ 注目すべきはBCL6とCRBNのタンパク質間相互作用が示唆されたこと
✓ BCL6 Gly55, Leu56主鎖カルボニル基とCRBN Arg373残基が水素結合
✓ BCL6 Arg94残基とCRBN Gly151主鎖カルボニル基が水素結合
✓ BCL6 Arg26残基とCRBN Phe150残基も距離的にπ-カチオン相互作用しているかも?
(BCL6 Arg26残基はBCL6 Asp88残基と分子内水素結合しているから微妙かも)

今回注目したいのは、2点です。
一つ目は、Kymera社とBMS社どちらも標的タンパク質とCRBNのタンパク質間相互作用が観察された点です。
以前にアステラスのKRAS degraderの事例を紹介した際にも同様に『KRAS(G12D)-VHL-ASP3082三者複合体 X線結晶構造解析において、KRAS(G12D)Glu62残基とVHLのArg69残基が相互作用を形成』と書きました。 三者複合体形成には標的タンパク質とE3 ligaseのタンパク質間相互作用がカギなのかもしれません。 そうすると、Dryで最初にタンパク質間相互作用を調整・予測して、後から化合物を間に入れて微調整するデザイン・シミュレーションするアプローチがとれるかも。 もちろん、化合物が結合することによってinduced fitが起こってそれがタンパク質間相互作用に寄与する可能性も考えられるので、例えば、標的タンパク質とリガンドの複合体、CRBNリガンドとCRBNの複合体、2つを近づけてタンパク質間相互作用が示唆される距離で、リンカーをデザインするとか? まぁ妄想ですけど。
アステラスの記事: https://azarashi-panda.hatenablog.com/entry/2025/09/15/064923
二つ目は、Kymera社とBMS社どちらも既知化合物から展開していますが、前者はCRBNリガンドとリンカーでつなぐ (コンジュゲート)前に物性調節を行っており、後者はコンジュゲート後に溶解度に課題が出てやり直している点です。基本的にコンジュゲート後はLogDやPSAは上がる傾向があるので、その前に物性調整してからの方がよさそうです。
いやぁ、メドケムって本当にいいものですね。