暗黒大陸を行く(上陸編)
前回の記事では、中外製薬が細胞内PPIを標的とした創薬アプローチとして、中分子創薬の一つである環状ペプチドのプラットフォームを構築したと報告した。環状ペプチドは母核が固定されているため、アミノ酸側鎖を変換することで大きな構造変化を伴わずに活性やADMETの最適化を行うことができる。
ドラッグライクな環状ペプチドの条件は、アミノ酸数 = 11個, CLogP ≧ 12.9, N-アルキル化 ≧ 6個で、ヒト肝ミクロソーム代謝安定性hLM CLint,mic ≦ 100 μL/min/mg proteinかつCaco-2細胞膜透過性 ≧ 0.40×10-6とcm/sだとin vivoにおける良好な代謝安定性と経口吸収性が期待できる。また、mRNAディスプレイ法とNCL(+脱硫化反応)を組み合わせることで、代謝の懸念があるジスルフィドやチオエーテルを避けた硫黄フリーの環状ペプチドを合成している。
今回は、構築したプラットフォームを創薬研究(KRAS阻害剤)への適用を紹介する。
ついに新しい世界に足を踏み入れた・・・ッ!

Validation of a New Methodology to Create Oral Drugs beyond the Rule of 5 for Intracellular Tough Targets
https://doi.org/10.1021/jacs.3c07145
【ハイライト】
1)ヒットペプチドAP8784はKRAS表面でInduced-fitを含む疎水性相互作用
2)AP8784から大きな構造変化や極性アミノ酸導入は伴わずにLUNA18を取得
【その1:ヒットペプチドAP8784はKRAS表面でInduced-fitを含む疎水性相互作用】
- コンセプト検証のためにmRNAディスプレイを細胞内タンパクKRASに適用した。
- mRNAディスプレイ(ペプチド数 ≧ 1010個)を実施し、KRASに結合が確認された7つの環状ペプチドを取得した。(SPRでKD = 0.34~9 μM)
- 最も結合親和性の高い環状ペプチドはAP8784であった。(KD = 0.34 μM)
- AP8784は、アミノ酸数 = 11個, CLogP = 12.7, N-アルキル化 = 7個だった。
- AP8784はKRAS(WT)とSOS1の相互作用をIC50 = 180 nMで阻害した。
【その2:AP8784から大きな構造変化や極性アミノ酸導入は伴わずにLUNA18を取得】
- AP8784からアミノ酸側鎖の変換のみで最適化を実施してLUNA18を取得した。
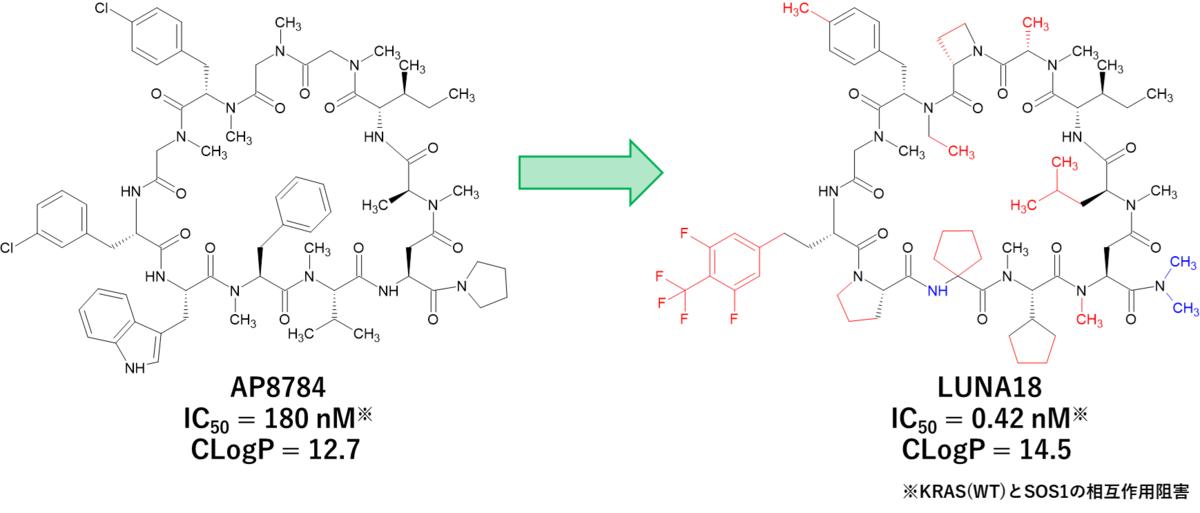
- LUNA18は良好なプロファイルは以下の通り。
- アミノ酸数 = 11個, CLogP = 14.5, N-アルキル化 = 8個で、hLM CLint,mic = 48 μL/min/mg proteinかつCaco-2 Papp = 2.3×10-6 cm/sであり、設定したドラッグライクな環状ペプチドのクライテリアを満たしている。
- KRASへの結合親和性や阻害活性は400倍以上向上した。(以下表を参照)
- 細胞系アッセイで細胞増殖を阻害した。(RASシグナル関連のみ)
- in vivo試験として、NCI-H441(KRAS-G12V)ゼノグラフトモデルマウスで腫瘍体積増加を用量依存で抑制しつつ、体重減少は観測されなかった。
- 種差に問題はなく、マウスやラットやイヌ、サルにおいて、低CL(1.3~8 mL/min/kg)および適度なVss(0.96~2.6 L/kg)、良好な生体内利用率(21~47%)であった。
- 選択性は、Eurofins社のCEREPパネル評価を実施して治療濃度域は充分と判断した。
- 10μMにおける阻害率は、塩化物イオンチャネル(GABA A)が69%, タキキニンNK-2受容体(NK2)が53%であった。
- PDE3Bが逆に−106%だったけど解釈どうなのかな、活性化かな。
- 現在、固形癌を対象疾患としてPhase1で開発中である。
|
Compound |
Assay |
GDP-KRAS WT |
GDP-KRAS G12C |
GDP-KRAS G12D |
GDP-KRAS G12V |
|
AP8784 |
SPR KD /nM |
340 |
- |
- |
- |
|
PPI IC50 /nM |
180 |
- |
- |
- |
|
|
LUNA18 |
SPR KD /nM |
0.035 |
0.038 |
0.033 |
0.031 |
|
PPI IC50 /nM |
0.42 |
0.46 |
0.58 |
0.55 |
今回、中外製薬が見出した環状ペプチドに関して、注目すべき点が3つある。
一つ目は、ドラッグライクなプロファイル(良好な細胞膜透過性と代謝安定性)は必ずしも低い分子量が良いのではなく、アミノ酸残基も8個より11個の方が良かった、という点である。これは、11残基の方が環構造がよりフレキシブルとなり、細胞膜(脂質膜)周辺では疎水性の配座を取って膜透過する一方で、水中では親水性の配座を取って良好な溶解性および酸化的代謝の抑制をもたらすためである。実際にシクロスポリンも11残基で同様のことが言われている。
参照:特殊ペプチド Specialty Peptide_ChemStation
https://www.chem-station.com/chemglossary/2016/05/specialty-peptide.html
二つ目は、アスパラギン酸やアルギニンのような電荷を持つ極性アミノ酸を含まない環状ペプチドで活性を示す点である。今回の事例でKRASに結合したAP8784やLUNA18は、以前に報告例のある極性アミノ酸を含む環状ペプチドと同じKRAS表面に結合していた。AP8784とKRASのX線結晶構造解析から想像すると、AP8784の疎水性アミノ酸残基がKRAS表面で相互作用を形成する際に、Induced-Fitが起こっている点がポイントかな。もちろん主鎖カルボニル基の水素結合も重要だろうけど。選択性もCEREPで充分と判断している。
参照:報告例のある極性アミノ酸を含む環状ペプチド
東大菅先生:https://doi.org/10.1021/acscentsci.0c00514
武田薬品:https://doi.org/10.1021/acsmedchemlett.7b00128
三つ目は、ヒットペプチドAP8784から臨床開発候補化合物LUNA18を見出すまでの最適化合成において、大きな構造変化を伴わずにアミノ酸残基の変換を中心に行った点である。最初にドラッグライクな環状ペプチドの条件を設定して、それに沿ってライブラリーのデザインやヒット選抜を行う戦略は素晴らしい。低分子創薬においても大きな構造変化は上手くハマれば新規性が高く活性や物性を両立した化合物が得られることもあるが大抵は両立が出来ず泥沼にハマってしまうことが多いと思う。今回のAP8784とLUNA18の構造を比較するとピッタリと重なり合っている。環状アミノ酸(アゼチジンやプロリン)やαジ置換アミノ酸(シクロペンチル)を導入して配座を固定しているのは、その辺を意識しているのかもしれない。一方で前述のフレキシビリティを損ないそうな気もするけど、計算に入れているのかな。
また、アミノ酸側鎖の変換で膜透過を改善できない場合はN-アルキル化アミノ酸のパターンを検討するのもアリと言っている。実際にAP8784からLUNA18への過程でC末(11番目)アスパラギン酸はNH体からN-Me体にメチル化され、9番目のフェニルアラニンはN-Me体からαジ置換アミノ酸のNH体に脱メチル化され、5番目のクロロフェニルアラニンはN-Me体からメチルフェニルアラニンのN-Et体に増炭され、調節している。
さすが中外さんや。中外さんで働きたい人生だった・・・。